16-04-2025 - Physics - Thermodynamic transformations [EN]-[IT]

~~~ La versione in italiano inizia subito dopo la versione in inglese ~~~
ENGLISH

16-04-2025 - Physics - Thermodynamic transformations [EN]-[IT]
With this post I would like to give a brief instruction about the topic mentioned in the subject
(code notes: X_64-63)
Thermodynamic transformations

image created with artificial intelligence, the software used is Microsoft Copilot
Introduction
First of all, let's start by trying to explain what thermodynamic transformations are.
Thermodynamic transformations basically describe the way a thermodynamic system evolves when it changes its state. The state of a thermodynamic system can change in terms of pressure, volume and temperature. These transformations are the foundation of thermodynamics and are divided into four main categories. These categories are isothermal transformations, isobaric transformations, isochore transformations and adiabatic transformations.
The four main thermodynamic transformations
Let's talk about the four most well-known thermodynamic transformations below.
An isothermal transformation is a transformation in which the temperature of the system remains constant, that is, the product of pressure and volume remains unchanged.
An isobaric transformation occurs when the pressure remains constant while the volume and temperature can vary.
An isochoric transformation occurs at constant volume, so the pressure changes as a function of temperature.
An adiabatic transformation is a thermodynamic transformation during which there is no heat exchange with the external environment.
The first law of thermodynamics
The first law of thermodynamics states that the change in internal energy of a system is equal to the difference between the heat exchanged by the system with the external environment and the work done between the system and the external environment. Below is its mathematical expression.
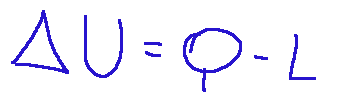
Where:
ΔU = the change in internal energy of the system
Q = heat exchanged with the environment (positive if absorbed, negative if given off)
L = the work done by the system (positive if the system does work, negative if it receives it).
The formula just described is an equation that establishes a thermodynamic principle of conservation of energy.
We can say that the energy acquired or lost by the system is given by the difference between two other forms of energy, heat, which can be absorbed or released, and work, which can be done by the system on the environment or vice versa.
Considerations on heat and work
As for heat, we can say that if it is absorbed by the system, therefore it is subtracted from the environment, then it is considered positive, if instead the heat is released by the system to the environment, then it is considered negative. Instead, as for work, it is considered positive when it is the system that does it on the environment, while it is considered negative if it is the environment that does the work on the system.
Transformations in gases

image created with artificial intelligence, the software used is Microsoft Copilot
Thermodynamic transformations in gases are those processes during which a gas changes state due to energy exchanges with the environment. This in the form of heat or work. The main thermodynamic transformations in gases are the same as those listed above, namely isothermal, isobaric, isochore and adiabatic.
Conservation of energy
We can say that the first law of thermodynamics, introducing the internal energy state function, allows the principle of conservation of energy to be extended to all systems.
Adiabatic transformations
An adiabatic transformation occurs when during this transformation there are no heat exchanges with the external environment. Therefore we can say that in it the heat exchanges between the system and the environment can be neglected, so the first law of thermodynamics assumes the following mathematical formula, where we see that the term Q disappears.
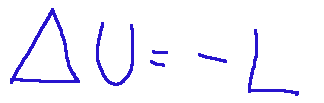
Isochoric transformations
In isochoric transformations the work is zero. Every variation of internal energy is due to heat exchanges for example with bodies at different temperatures. Therefore its mathematical form is the one expressed below.
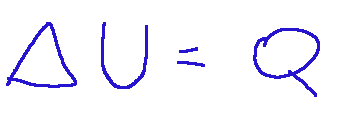
Conclusions
Thermodynamic transformations are essential concepts for understanding phenomena such as the functioning of engines, refrigerators and atmospheric currents. We can therefore say that around us, during our daily lives, several important thermodynamic transformations occur.
Question
The first law of thermodynamics is one of the fundamental laws of physics. Did you know that the first to experimentally demonstrate that heat and work are two equivalent forms of energy was the English physicist James Prescott Joule?

ITALIAN

16-04-2025 - Fisica - Trasformazioni termodinamiche [EN]-[IT]
Con questo post vorrei dare una breve istruzione a riguardo dell’argomento citato in oggetto
(code notes: X_64-63)
Trasformazioni termodinamiche

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Introduzione
Innanzitutto, partiamo con il cercare di spiegare che cosa sono le trasformazioni termodinamiche.
Le trasformazioni termodinamiche sostanzialmente descrivono il modo in cui un sistema termodinamico evolve quando cambia il suo stato. Lo stato di un sistema termodinamico può cambiare in termini di pressione, volume e temperatura. Queste trasformazioni costituiscono le fondamenta della termodinamica e sono divise in quattro categorie principali. Queste categorie sono le trasformazioni isoterma, le trasformazioni isobare, le trasformazioni isocore e le trasformazioni adiabatiche.
Le quattro principali trasformazioni termodinamiche
Parliamo qui di seguito delle quattro trasformazioni termodinamiche più note.
La trasformazione isoterma è una trasformazione in cui la temperatura del sistema rimane costante, cioè il prodotto tra pressione e volume resta invariato.
La trasformazione isobara avviene quando la pressione rimane costante mentre il volume e la temperatura possono variare.
La trasformazione isocora invece avviene a volume costante, quindi la pressione cambia in funzione della temperatura.
La trasformazione adiabatica è una trasformazione termodinamica durante la quale non avvengono scambi di calore con l’ambiente esterno.
Il primo principio della termodinamica
Il primo principio della termodinamica stabilisce che la variazione di energia interna di un sistema è uguale alla differenza tra il calore scambiato dal sistema con l’ambiente esterno e il lavoro esercitato tra il sistema e l’ambiente esterno. Qui di seguito la sua espressione matematica.
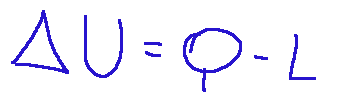
Dove:
ΔU = la variazione dell'energia interna del sistema
Q = calore scambiato con l'ambiente (positivo se assorbito, negativo se ceduto)
L = il lavoro compiuto dal sistema (positivo se il sistema compie lavoro, negativo se lo riceve).
La formula appena descritta è un’equazione che stabilisce un principio termodinamico di conservazione dell’energia.
Possiamo dire che l’energia acquisita o persa dal sistema e data dalla differenza di altre due forme di energia, il calore, che può essere assorbito o ceduto, e il lavoro, che può essere svolto da sistema sull’ambiente o viceversa.
Considerazioni sul calore e sul lavoro
Per quanto riguarda il calore, possiamo dire che se viene assorbito dal sistema, dunque viene sottratto all’ambiente, allora viene considerato positivo, se invece il calore viene ceduto dal sistema all’ambiente, allora è considerato negativo. Invece per quanto riguarda il lavoro, esso è considerato positivo quando è il sistema a compierlo sull’ambiente, mentre è considerato negativo se è l’ambiente a compiere il lavoro sul sistema.
Trasformazioni nei gas

immagine creata con l’intelligenza artificiale, il software usato è Microsoft Copilot
Le trasformazioni termodinamiche nei gas sono quei processi durante i quali un gas cambia stato a causa di scambi di energia con l’ambiente. Questo sotto forma di calore o lavoro. Le principali trasformazioni termodinamiche nei gas sono le stesse che abbiamo elencato prima, cioè le isoterma, le isobare, le isocore e le adiabatiche.
Conservazione dell’energia
Possiamo dire che il primo principio della termodinamica, introducendo la funzione di stato energia interna, consente di estendere a tutti i sistemi il principio della conservazione dell’energia.
Trasformazioni adiabatiche
Una trasformazione adiabatica avviene quando durante questa trasformazione non avvengono scambi di calore con l’ambiente esterno. Quindi possiamo dire che in essa possono essere trascurati gli scambi di calore tra il sistema e l’ambiente per cui il primo principio della termodinamica assume la seguente formula matematica, dove vediamo che scompare il termine Q.
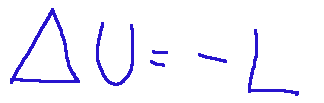
Trasformazioni Isocore
Nelle trasformazioni isocore il lavoro è nullo. Ogni variazione di energia interna è dovuta a scambi di calore ad esempio con corpi a temperature diverse. Quindi la sua forma matematica è quella espressa qui sotto.
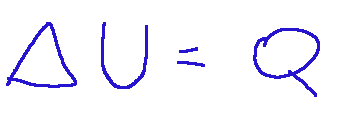
Conclusioni
Le trasformazioni termodinamiche sono concetti essenziali per comprendere fenomeni come il funzionamento dei motori, dei frigoriferi e le correnti atmosferiche. Possiamo quindi dire che intorno a noi, durante la nostra vita quotidiana, avvengono diverse ed importanti trasformazioni termodinamiche.
Domanda
Il primo principio della termodinamica è una delle leggi fondamentali della fisica. Lo sapevate che il primo a dimostrare sperimentalmente che calore e lavoro sono due forme equivalenti di energia, fu il fisico inglese James Prescott Joule?
THE END
learning physics is an interesting thing.
https://x.com/jewellery_all/status/1912415644471214270
Wow this is actually so transformative
Thank you so much for always taking quality time to explain this
Thanks for stopping by. In thermodynamics, one of the main concepts is that the change in internal energy is equal to heat minus work. Heat is the heat absorbed by the system, while work is the work the system does on the environment. !WINE
This is a great course and even self explanatory
Thank you!
Thanks for stopping by. I don't know why, but thermodynamic transformations have always caught my attention. Maybe also because it is one of the topics that I understood well right away. I like how adiabatic, isobaric, isochore and isothermal thermodynamic transformations can be managed in sequence, and in various sequences !DIY
Ciao @stefano.massari, ti ho detto che NON ti farò più scherzi, ma, ma, penso, che tu sia un uomo molto serio, rimarrai sorpreso se ti dico che lo sono anche io, il mio aspetto è da ragazzo serio, sai che sono sincero, ma mi piace sorridere, NON prendo in giro nessuno, beh al punto hahahaha, alle donne piace un uomo che sorride con loro, senza esagerare, se fai qualche scherzetto a tua moglie vedrai che si avvicinerà a te, NON intendo dire che non è vicina hahaha, mi hai capito ....Non dirò altro
Grazie per questo messaggio. Puoi farmi tutti gli scherzi che vuoi… sono io che essendo poco spiritoso a volte comprendo le tue battute e a volte purtroppo no !PIMP
@stefano.massari, I paid out 0.144 HIVE and 0.033 HBD to reward 2 comments in this discussion thread.